Iron Response ElementS
![]() ESTADO DE ARTE DEL TEMA
ESTADO DE ARTE DEL TEMA
![]()
![]() IRPs
IRPs
Las proteínas IRPs, (IRP-1 and IRP-2) son homologos de la superfamilia de las aconitasas. Sorprendentemente como sucedía con los mRNAs con IREs, la identidad de secuencia se encuentra mucho más conservada entre especies que entre IRP-1 y IRP-2 de la misma especie (90% vs 60-70%).
Aunque IRP-1 (98KD) fue la primera IRP en ser identificada su naturaleza todavía no ha sido bien caracterizada. Cuando se comparan péptidos de IRP-1 con péptidos de la aconitasa citoplasmática, se obtienen identidades superiores al 98%. Estudios complementarios han mostrado a través de técnicas cristalográficas como la aconitasa presenta en la hendidura localizada entre las dos subunidades un cluster Fe-S. Cluster (Fe4S4) que puede precisamente convertir in vitro IRP-1 en aconitasa. Asumiendo que las inserciones específicas de IRP se encuentran exclusivamente en los loops más superficiales y que no afectan al plegamiento, el punto de unión del IRE tiene que encontrarse próximo o debe ser el mimo que la hendidura en la que se encuentra el cluster Fe-S. Es por ello que se ha sugerido que IRP-1 cicla entre una forma de unión al RNA y la aconitasa citoplasmática en función de la presencia o absencia del cluster 4Fe-4S. Sería por tanto más adecuado hablar de una proteína bifuncional. El hierro en función del estatus celular podría dirigir la regulación del IRP-1 construyendo o no un cluster Fe-S en la hendidura que bloquearía la actividad de unión al mRNA.
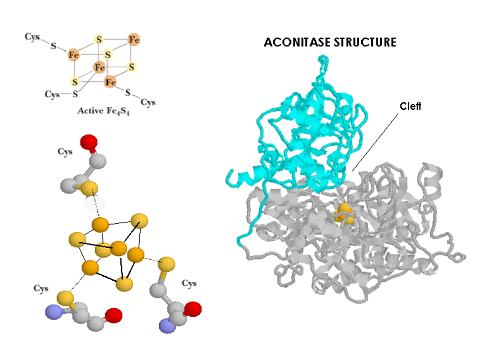
Aunque IRP-2 (105KD) es bastante similar a IRP-1 (61% de homología en la secuencia) no forma ningún tipo de cluster Fe-S. La diferencia en la secuencia reside en una inserción de 73 aminoácidos única en IRP-2 cercana a la región amino terminal. IRP-2 en comparación con IRP-1 no se encuentra regulada estructuralmente por el hierro. Lo que el hierro media en este caso es el descenso del pool citoplasmático de IRP-2 a través de la oxidación de la proteína seguida de su ubiquitinación y degradación proteasomal.
El estado oxidado-reducido de los residuos de cisteinas en ambas IRPs y la unión del cluster Fe-S en el caso de IRP-1, puede influenciar la unión al RNA y proporcional una zona pontencial para la regulación por oxígeno/hipoxia, óxido nítrico, ascorbato, peróxido de hidrógeno y varios oxoradicales (recalcar que todos estos estímulos nos conducen a todo el resto de proteínas ya mencionadas anteriormente que también presentan IREs en sus mRNAs).