Introducció
Les selenoproteïnes
El seleni; de la necessitat a la toxicitat
El seleni (Se) és un element traça essencial per a qualsevol organisme. A través de la selenocisteïna i en consequència de les selenoproteïnes, el seleni participa en diversos processos biològics fonamentals com: defensa immunològica, efecte antioxidant i protecció antitumoral. El dèficit de seleni està clarament relacionat amb l'aparició de diverses malalties relacionades amb estrés oxidatiu, de la mateixa manera, en excés, tambè s'ha observat que causa toxicitat. Nombrosos estudis presenten capacitats antitumorals al seleni mentre que d'altres el relacionen amb certs tumors. El que queda clar és que les selenoproteïnes tenen un paper essencial en la minimització del dany oxidatiu cel·lular.[1] [2].
El seleni es troba en tots els regnes de la vida terrestre. Intracel·lularment es troba sempre formant part de selenoproteïnes, mai en forma lliure. D'aquesta manera s'evita la seva toxicitat i es garanteix la seva funcionalitat com element essencial. El seu gran poder antioxidant rau en l'alta activitat catalítica en reaccions redox que atorga a les proteïnes que incorporen seleni en el seu centre actiu.[3].
Tornar a dalt
Selenoproteïnes
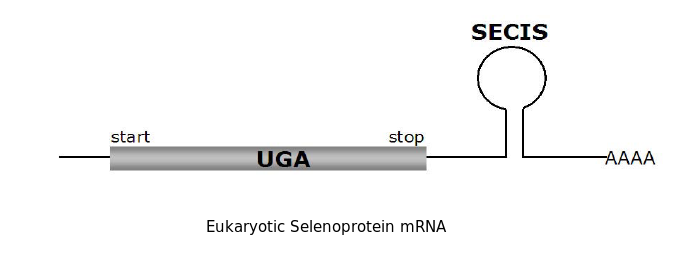
Les proteïnes que contenen selenocisteïna (Sec) han estat identificades en tots els dominis de la vida. En aquestes proteïnes la Sec està codificada per el codó UGA. Aquest codó normalment és un codó d'STOP. La traducció de la Sec és possible quan es troba un element SECIS en la posició 3' de les regions no traduïdes dels gens de selenoproteïnes en eucariotes i archaea i immedatament downstream del codó que codifica per la Sec en bacteris. El conjunt de selenoproteïnes d'un genoma es diu selenoproteoma i en el cas de l'humà està format per 25 gens i 24 proteïnes [4]
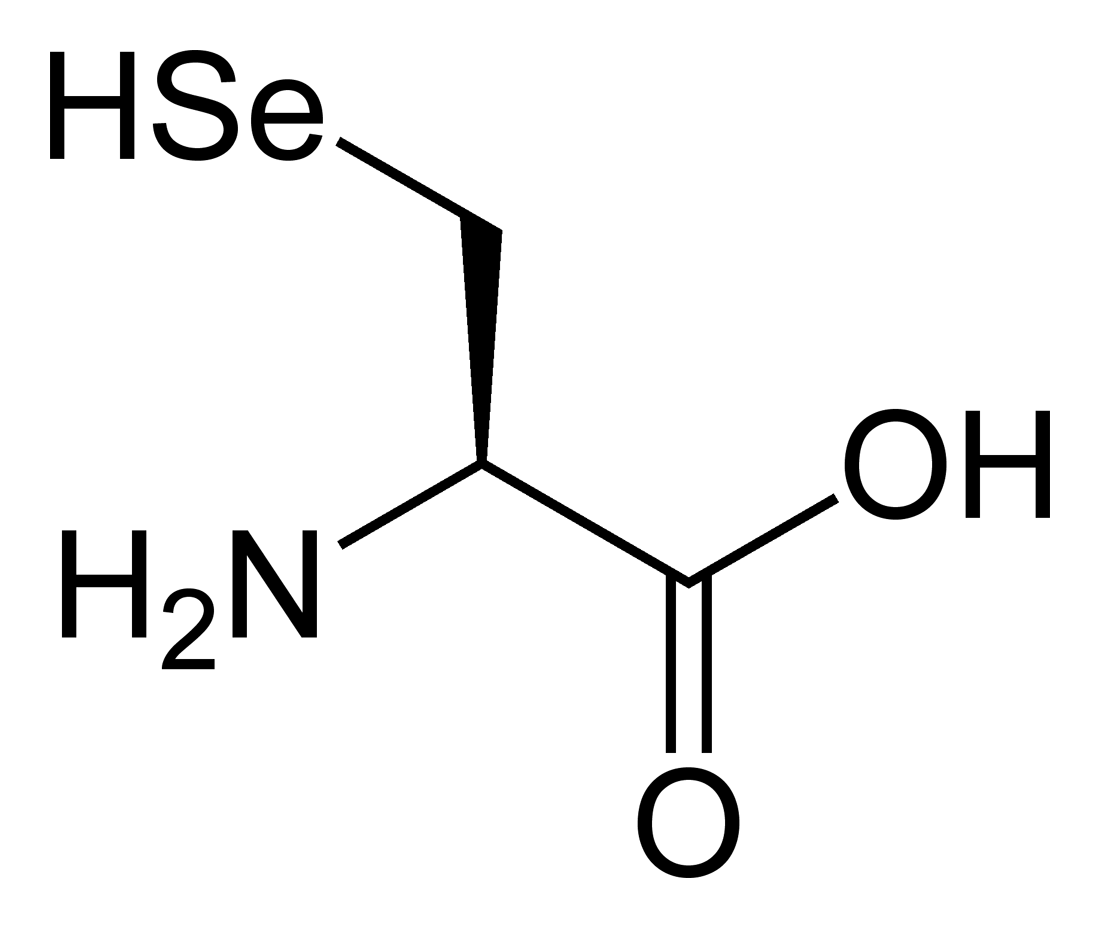
La selenocisteïna, és un anàleg de l'aminoàcid cisteïna amb la modificació d'incorporar un àtom de seleni en comptes d'un de sofre. La presència del seleni atorga un potencial redox molt elevat a aquestes proteïnes, activitat que com ja s'ha comentat anteriorment atorga un gran poder antioxidant a aquestes proteïnes i en conseqüència el seu paper com a agents antitumorals i protectors davant de l'estrés cel·lular.[5]
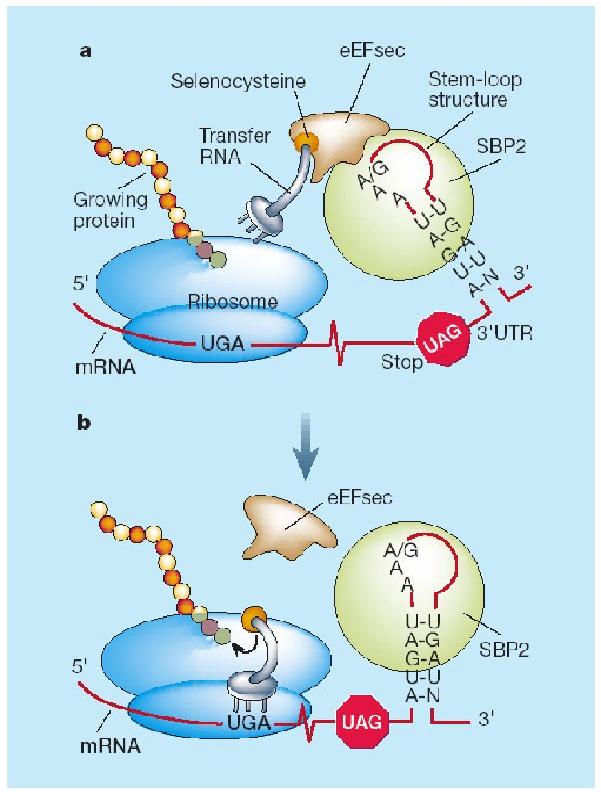
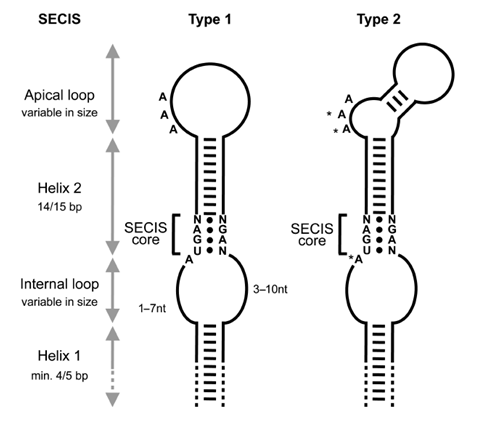
La incorporació d'aquest aminoàcid requereix la presència del codó UGA seguit en l'extrem 3' d'aquest RNA d'una estructura tridimensional en forma de loop anomenada SElenoCystein Insertion Sequence (SECIS). Aquesta estructura permet reclutar la maquinària de traducció de la selenocisteïna i evitar la interrupciò de la traducci´. El fet de que l'aminoácid selenocisteïna estigui codificat per un codó d'STOP propicia que la identificació de selenoproteïnes sigui costosa i la seva anotació sovint errònia.[6]
Dels més de 500 genomes que han estat seqüenciats d'eubacteris sols un 20 % contennen la maquinària necessària per a la síntesi de selenoproteïnes. En eucariotes s'ha trobat la maquinària d'inserció de la Sec en diversos organismes simples com algues i en animals mentre que es troba absent tant en fongs com en plantes superiors.[7] Tornar a dalt
Síntesi de selenoproteïnes
Com ja hem dit anteriorment l'aminoàcid selenocisteïna és codificat pel codó UGA, aquest mateix codó é una senyal d'stop, per tant el ribosoma requereix una senyal especial per a tal de reclutar la maquinària de síntesi de selenocisteïna. en eucariotes, aquest senyal és l'estructura secundària tridimensional d'RNA SeCIS que es troba en l'extre, 3' UTR dels gens de selenoproteïnes.[8]
L'element SECIs recluta la proteïna SeCIS binding Protein (SBP2), aquesta proteïna al seu torn recluta un factor d'elongació específic de selenoproteïnes (EFsec). Aquesta proteïna és la encarregada de seleccionar específicament el tRNA unit a SeCys i l'apropa el codó UGA del mRNA. D'aquesta manera s'incorpora la Selenopcisteïna. I la traducció continua fins que el ribosoma troba un nou codó de terminació.
La maquinària de síntesi de selenoproteïnes té la capacitat de distingir entre els dos codons UGA i aquesta rau en la distància entre el codó UGA i l'estructura SECIs.[9]
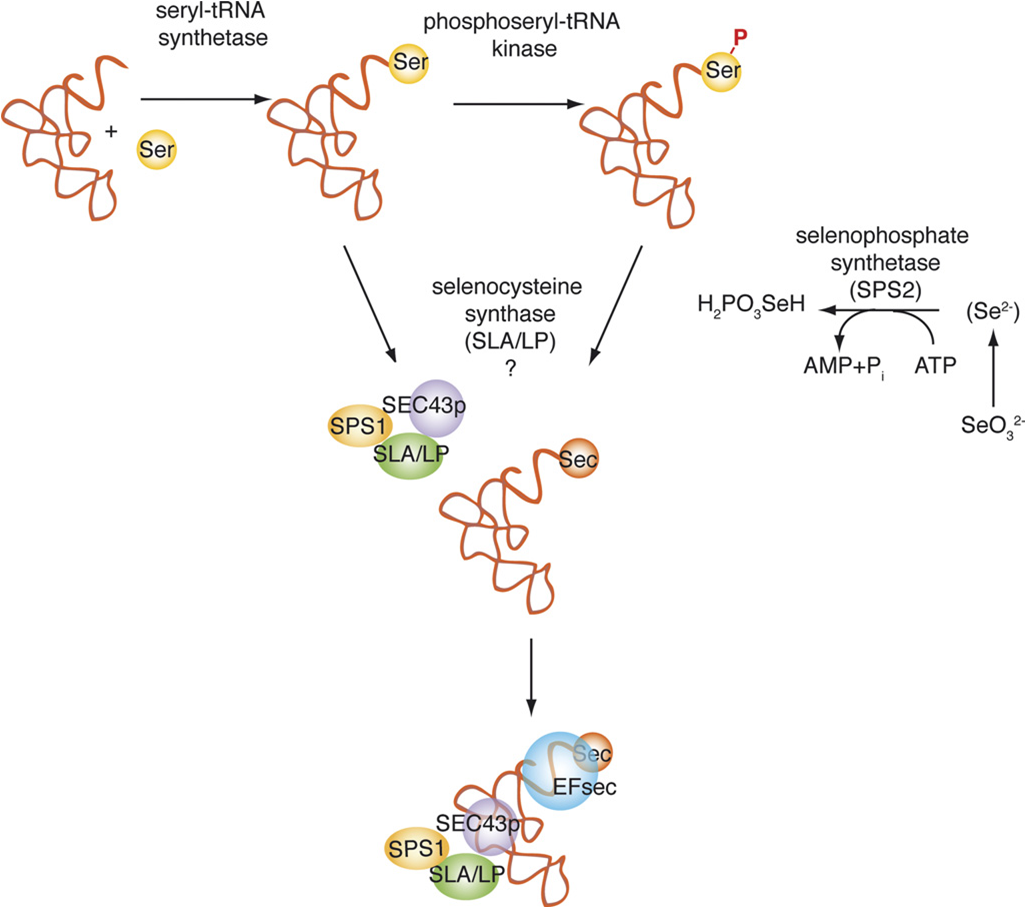
Per a la síntesi del aminoá Sec hi ha diferents enzims implicats; la selenofosfat sintetasa (SPS1 i SPS2), la selenocisteïna sintasa (SLA/LP), la fosfoseril tRNA quinasa (PTSK) i la proteïna associada a selenocisteïna (SECP43). Cal dir que el tRNA es sintetitza a partir del tRNA de la cisteïna. [5] [10]
Tornar a dalt
Anotació i predicció
Com ja s'ha comentat anteriorment, el fet que el codó UGA sigui el que codifica per la selenocisteïna fa que les selenoproteïnes estiguin en molts casos mal anotades ja que no s'interpreten correctament aquests codons. Per tal de solucionar-ho cal fixar-se en la cerca de la seqüència de l'estructura SECIs en l'extrem 3' del mRNA no traduït. Aquestes estructures contenen 4 aminoàcids molt conservats al core responsables de dirigir la maquinària de traducció.[5]
Tornar a dalt
Evolució de les selenoproteïnes
Tal com s'ha comentat amb anterioritat, aquesta família de proteïnes s'ha observat en tots els dominis de la vida, malgrat aixó, hi ha diverses diferències entre organismes fruit de la especiació i l'evolució.
Els anàlisis del selenoproteoma de diferents eucariotes han demostrat que hi ha diferèrencies entre espècies. Un exemple és que els vertebrats i les algues verdes tenen més de 20 selenoproteïnes mentre que les algues vermelles i els insectes en tenen menys de 5. També s'ha vist que els organismes aquàtics tenen més selenoproteïnes que els terrestres així com també que els mamífers tenen tendéncia a perdre-les.
Comparant els genomes de peixos i de mamífers s'ha vist que hi ha certes duplicacions de selenoproteïnes en els peixos mentre que en mamífers se n'han trobat de noves fruit de duplicacions ocorregudes desprès de la separació dels peixos. Un expemple d'aquestes selenoproteïnes presents en mamífers podria ser la GPx6 i la SelV, aparegudes per duplicacions de la GPx3 i la SelW respectivament.
La hipòtesi postulada anteriorment que els mamífers han tendit a perdre les selenoproteïnes es suporta pel fet de que selenoproteïnes com la SelJ o la SelL es trobin sols en peixos. En el nostre cas, la Chrysemys picta belli es troba en un estadi intermig ente peixos i mamífers, així que esperaríem trobar característiques d'ambdós grups.

Tornar a dalt
Chrysemys picta bellii
La Crysemys picta (tortuga pintada) és l'únic membre del gènere Chrysemys. Forma part de la família Emydidae i de la classe reptilia. Aquesta espècie de tortuga comprèn 4 subespècies, entre les quals hi ha la Chrysemys picta bellii. Aquesta és la tortuga més extesa de Nord-Amèrica. Viu en hàbitats humits, des de Lousiana fins al sud de Canadà i la seva capacitat adaptativa a l'anòxia i al fred ha estat un dels elements d'aquest individu que han succitat més interès.[11]

Tornar a dalt
Taxonomia i evolució
El gènere Chrysemys, com s'ha esmentat anteriorment, només està format per una única espècie: picta. Aquesta, està formada per quatre subespècies: Chrysemys picta picta, Chrysemys picta dorsalis, Chrysemys picta marginata i finalment, la nostra espècie estudiada: Chrysemys picta bellii. Aquesta tortuga va ser descoberta l'any 1783 i classificada el 1831 com a subespècie picta belli, es creu que aquestes van divergir fa uns 100000 anys. S'han trobat fòssils que demostren que les Chrysemys picta porten a la terra entre 5 i 15 MA. Tambè cal dir que la seva situació taxonòmica així com la existéncia de les subespécies és avui encara un motiu de debat.[11]
Tornar a daltDescripció
La tortuga medeix uns 15-25 cm. La seva closca superior té una coloració en forma de raig de llum mentre que la closca inferior té una gran taca de colors que s'extén per tota la superfície essent normalment de coloració vermellosa. El seu cap també és un element distintiu, la seva coloració està conformada per una sèrie de línies grogues en forma de V. A nivell microscòpic, es poden observar petites crestes i canals a la closca característics d'aquesta espècie. Les femelles són sensiblement més grans que els mascles mentre que aquests tenen la cua més llarga.[11]
Tornar a daltAlimentació i hàbitat
L'alimentació de la Chrysemys picta belli es basa majoritàriament en plantes i insectes tot i que també es pot alimentar de llavors. El seu hàbitat són les aigües fresques del Nord d'Amèrica. És l'única tortuga del continent que el seu hàbitat comprèn des de Canadà fins al golf de Mèxic i des de la costa Pacífica fins a l'Atlàntic. Cadascuna de les quatre subespècies té una àrea del continent on és predominant. La picta bellii concentra el seu hàbitat en els estats del nord centre dels Estat Units d'Amèrica. Aquesta tortuga roman la major part del temps sota l'aigua i només surt per migrar. En els seus hàbitats és la tortuga més extesa arribant a assolir valors de densitat de fins a 250 exemplars per hectàrea.[11]
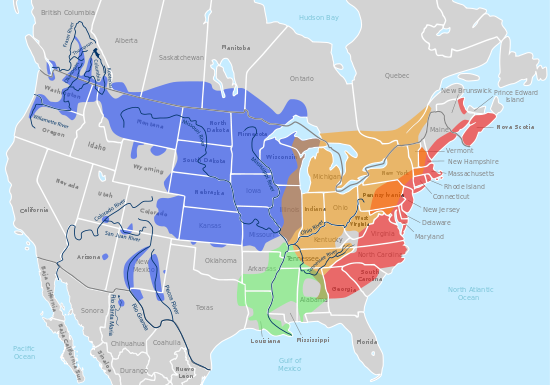
Eastern (C. p. picta)
Midland (C. p. marginata)
Southern (C. p. dorsalis)
Western (C. p. bellii)
Tornar a dalt
Seqüenciació i Genoma
El motiu de la seqüenciació del genoma de la Chrysemys picta belli és que aquesta tortuga és un model per a l'estudi de la tolerància al fred,la tolerància a la hipòxia, la determinació sexual per temperatura i també per a l'estudi de l'evolució dels vertebrats.
El genoma mitocondrial de la tortuga va ser seqüenciat el 1999 amb l'objectiu de situar les tortugues dins la història evolutiva dels vertebrats. S'ha vist que les tortugues tenen una distribució del genoma mitocondrial més semblant a la dels mamífers i més distant als altres rèptils com els cocodrils o les serps. Les taxes de variació del genoma mitocondrial de les tortugues són relativament baixes en contraposició a les que presenten serps i cocodrils ja que la posició de les tortugues en la filogènia dels vertebrats és encara un problema.[13]
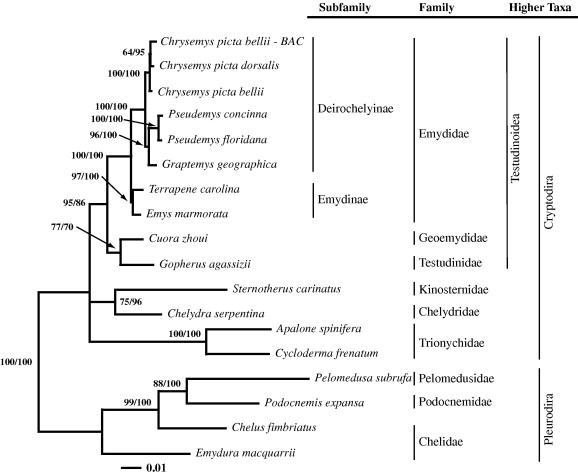
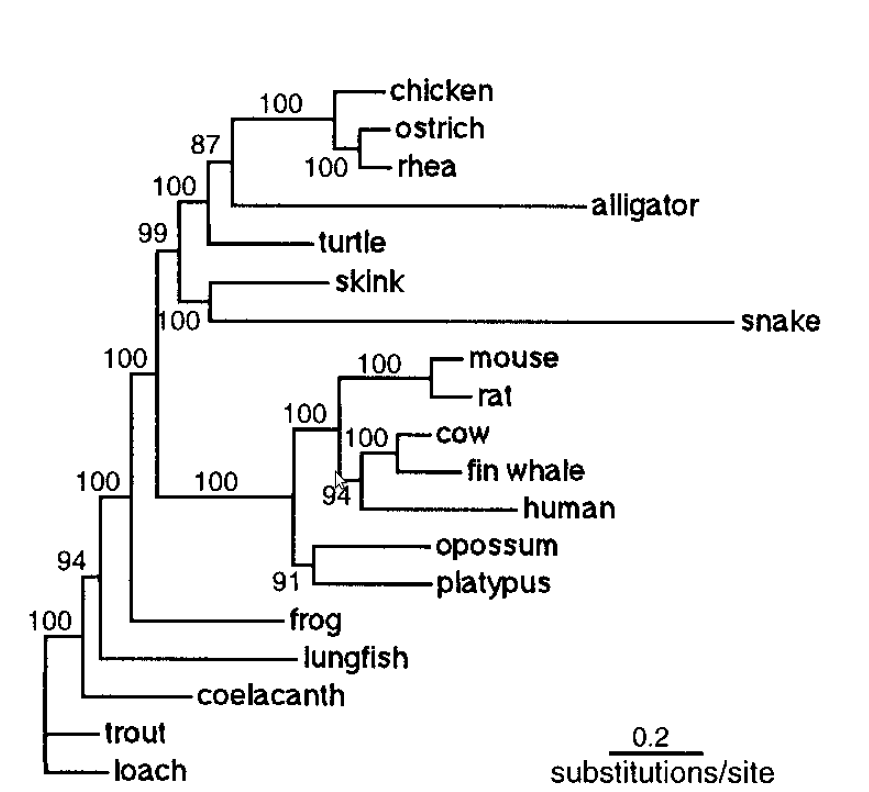
A les figures apareixen dos arbres filogenètics que mostren la relació de la Chrysemys picta belli amb altres rèptils així com la seva posició dins dels vertebrats.
Amb tot aquest interès científic, es va crear un consorci que ha acabat amb la seqüenciació i l'assamblatge del genoma d'aquesta tortuga. De moment hi ha molt poques proteïnes anotades i totes fan referència a processos respiratoris. Els aliniaments utilitzats per l'assamblatge del genoma es van fer amb els genomes del pollastre i d'Anolis lizard.[14]
De les espècies que es troben ben anotades, la que és filogenèneticament més semblant a la tortuga pintada és Gallus gallus. Tot i aixï, la base de dades de selenoproteïnes de Gallus gallus no era del tot completa, per aquest motiu vam considerar més important utilitzar les querys provinents d'Homo sapiens. L'estructura del seu genoma consta de 50 cromosomes, 26 dels quals són macrocromosomes i 24 microcromosomes. Va ser seqünciat al 2009 i assemblat el 2010.[11]
Tornar a daltImportància científica
Les tortugues de latituds meridionals han hagut de desenvolupar mecanismes que els permetin resistir els llargs períodes d'hivernació que passen cada any. Algunes d'aquestes espécies, inclosa la Chrysemys picta bellii han desenvolupat estratègies que permeten a aquests quelonis poder resistir durant períodes perllongats les situacions d'hipòxia i anòxia que experimenten sota l'aigua gelada dels llacs on romanen durant l'hivern. En aquestes situacions, l'aport d'oxigen que necessiten aquestes tortugues prové de l'oxigen dissolt en l'aigua i no de l'oxigen de l'aire obtingut mitjançant la respiració pulmonar. Explotant aquest sistema de captació d'oxigen, aquestes tortugues aconsegueixen arrelentir el metabolisme anaeròbic i evitar l'acidosi làctica. Quan la temperatura ambient augmenta, aquest sistema continua sent important ja que permet a la tortuga allargar les capbussades. De totes maneres, la demanda metabòlica augmenta en incrementar la temperatura, i aquest mecanisme de captació d'oxigen extrapulmonar passa a ser a ser residual.[15]
Aquesta gran capacitat adaptativa a la hipòxia ha succitat que la Chrysemys picta belli sigui la protagonista de nombrosos estudis científics que analitzen els mecanismes que permeten a aquesta tortuga resistir aquests perídes tant prolongats d'hipòxia i quines consequències adaptatives ha tingut en l'organisme.Un exemple és la capacitat que té aquesta tortuga per coordinar els nivells d'ATP amb el flux iònic, aquest mecanisme es essencial per permetre que la tortuga pugui resistir una anòxia perllongada. Tot i que els sistemes moleculars d'aquesta adaptació generalment encara romanen poc clars, hi ha nombrosos estudis que defensen el paper crucial de l'adenosina en la senyalització, que permet a l'organisme de la Chrysemys picta bellii adaptar-se a l'anòxia. Alguns dels efectes de l'adenosina que s'han pogut comprovar han estat: la promoció de la glicogenòlisi per permetre la glicòlisi anaeròbica, l'estimulació de la glicòlisi, així com la disminució de la excitabilitat neuronal per permetre la reducció dels requeriments energètics neuronals. Aquesta senyalització implicaria l'acció inhibidora de l'adenosina sobre els receptors de NMDA amb la funció de reduir l'excitibilitat neuronal.[16]
Tornar a dalt