__________________________________________________________________________________________________
_________________________________________________________
En aquest treball presentem la caracterització de l'estructura exònica, homologia, funció i expressió dels gens humans que codifiquen per les proteïnes PML i RAR. Aquestes dues poden formar una proteïna de fusió quan es produeix una translocació cromosòmica entre els cromosomes 15 i 17. La leucèmia promielocítica aguda (APL), la malaltia associada a la proteïna de fusió estudiada, es caracteritza per la deficiència de cèl·lules sanguínies madures i un excés de cèl·lules immadures, els promielòcits. La proteïna codificada pel gen PML és un component d'un complex multiproteïna, els cossos nuclears, amb moltes variants les funcions de les quals encara són confuses. L'altra proteïna que forma la proteïna de fusió és la variant alfa dels receptors de l'àcid retinoic, localitzada al nucli i molt implicada en el desenvolupament de l'individu (l'àcid retinoic és un important morfogen), sobretot en la diferenciació i morfogènesi cel·lular. Les dues proteïnes segueixen la història evolutiva, tenint una major homologia en primats, malgrat que la seva conservació amb els diferents gens ortòlegs no és elevada. La seva expressió en teixits difereix: PML es troba en elevades quantitats en vasos, nervis i òs, mentre que RARA s'expressa majoritàriament en cor, melsa i tracte gastrointestinal.
En aquesta pàgina web presentem un estudi computacional sobre la proteïna de fusió PML-RAR. Aquesta proteïna és patològica i es troba en individus que presenten una translocació cromosòmica recíproca t(15;17), on el cromosoma translocat pot ser tant el quinze com el disset. Aquesta alteració cromosòmica deriva en un tipus de leucèmia: la leucèmica promielocítica aguda. Justament va ser l'estudi d'aquesta patologia la que va permetre descobrir la proteïna de fusió i una de les dues proteïnes que la formen, la PML (promyelocytic leukemia protein). L'altre component, RARA, és una proteïna de la família dels receptors de l'àcid retinoic.
Per poder estudiar la PML-RAR, el treball basa la seva part central en l'estudi diferencial i comparatiu de les dues proteïnes que la formen: comencem descrivint l'estructura genòmica dels dos gens en condicions no patològiques, mostrem els diferents gens ortòlegs en altres espècies per determinar la conservació de les dues proteïnes al llarg de l'evolució, descrivim l'expressió i la funció dels dos gens, així com una breu explicació sobre la patologia que provoca l'expressió de la proteïna de fusió. Finalment presentem una hipòtesi sobre els factors de transcripció que poden unir-se amb una alta probabilitat a la regió promotora dels dos gens i que són responsables de la regulació d'aquests. Aquesta hipòtesi la fem basant-nos, d'una banda, en el servidor web del programa PROMO i, de l'altra, amb un programa elaborat per nosaltres amb llenguatge Perl, que ens permetrà, donades unes matrius d'ocurrències i una seqüència de nucleòtids (que serà la regió promotora que es vulgui analitzar), determinar quins factors de transcripció dels que s'hagin entrat en forma de matriu s'uneixen al promotor.
Per fer l'estudi genòmic computacional de la proteïna PML-RAR hem utilitzat diferents bases de dades disponibles a Internet. Per a l'estudi de l'estructura genòmica hem utilitzat:
Per trobar els gens ortòlegs i determinar la conservació dels gens d'interès al llarg de l'evolució hem utilitzat:
Per determinar els diferents teixits on s'expressen les diferents proteïnes hem utilitzat:
Alguna vegada ens hem trobat amb divergències i informació incoherent i que no coincideix en totes les bases de dades. Ha estat llavors quan hem hagut d'escollir una base de dades de referència, la tria de la qual hem fet segons diferents criteris i amb la supervisió del professor que ens assessorava a les pràctiques. De totes maneres, sempre hem intentat reflectir tota la informació possible i raonar, en cada cas, el per què d'escollir una font d'informació determinada.
Per determinar els possibles factors de transcripció que s'uneixen en una regió promotora hem usat:
Per fer el programa Perl i el redactat d'aquesta pàgina en format HTML, hem treballat amb el sistema operatiu Linux, i amb les diferents eines que aquest proporciona.
Per estudiar la funció dels dos gens hem utilitzat:
PML-RAR és una proteïna de fusió fruit de la translocació cromosòmica t(15;17) (q22;q11.2-q12), associada a la leucèmia promielocítica aguda (APL). El gen de la proteïna quimèrica té 3036 parells de bases, dels quals formen la seqüència codificant (CDS) des del nucleòtid 67 al 2460 formant 797 aminoàcids (més el codó stop). Elaborarem aquest treball estudiant per separat les dues proteïnes que conformen la proteïna de fusió, així com els dos gens associats.
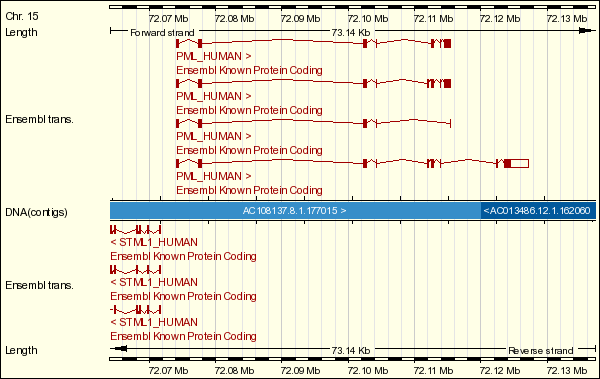
La primera proteïna que conforma la quimèrica PML-RAR és la proteïna PML (promyelocytic leukemia protein), component d'un complex multiproteic i identificada, originalment, en pacients que patien leucèmia promielocítica aguda (APL). El locus genòmic de PML es troba al cromosoma 15q22 (a la localització 72.074.067 - 72.127.204) i està format per onze exons. Se sintetitzen un gran nombre de transcrits des del gen de PML a causa de l'splicing alternatiu, provocant una gran varietat d'isoformes, que s'estenen en pes molecular des de 48-97 kDa.
Figura 1. Representació gràfica dels transcrits del gen PML.
A la base de dades ENSEMBL es descriuen quatre transcrits (de cinc, set, vuit i nou exons respectivament). Aquests transcrits inclouen conjunt d'exons diferents a causa de l'splicing alternatiu citat anteriorment. El transcrit de cinc exons té una llargada de 1448 parells de bases que codifiquen per una proteïna de 435 residus i 140 nucleòtids que conformen la regió UTR 5'. El transcrit de set exons té una llargada de 2486 parells de bases que conformen una regió UTR 5' i codifiquen per una proteïna de 781 residus. El transcrit de vuit exons té una llargada de 2630 parells de bases que, com els altres, conforma la regió UTR 5' i una proteïna de 829 residus. Per últim, el transcrit de nou exons, té una llargada de 5591 parells de bases que codifiquen per una proteïna de 882 residus i, a més, inclou una regió UTR (no codificant) 5' i una UTR 3'. Per tant, podem veure que els transcrits no tenen exons no codificants, tret de les regions UTR, que formen part d'alguns exons, però no són exons complets.
Taula 1. Representació dels transcrits del gen PML.
Per trobar les diferents isoformes sortides d'aquest transcrit, ens basem en la base de dades UniProt, que ens indica que té cinc isoformes diferents. Malgrat tot, la literatura ens diu que se'n coneixen setze de diferents, i a la base de dades Genome Browser, ens n'apareixen deu. Ens basem amb UniProt, doncs, per mantenir els mateixos criteris a l'hora d'analitzar les dues proteïnes que formen la proteïna de fusió i perquè la informació de Genome Browser tampoc coincideix amb el que hem trobat a la literatura. Per tant, analitzant les cinc isoformes trobades a UniProt, veiem que la primera isoforma és exactament igual al transcrit de nou exons, cosa que ens fa suposar que les diferències afecten a una porció no codificant. Pel que fa a la segona isoforma, provindria del transcrit de cinc exons, malgrat que la proteïna que donaria el transcrit no és exactament igual a la isoforma, sinó que fent un ClustalW veiem que l'alineament té una puntuació de 97. Alineant la tercera isoforma amb les proteïnes que ens proporciona l'ENSEMBL provinents dels diferents transcripts, obtenim una puntuació de 99 tant amb el transcrit de set exons com amb el de vuit, de manera que no podem determinar a quin transcrit està associat aquesta isoforma. La isoforma quatre està associada al transcrit de vuit exons, amb una puntuació de 98 quan en fem un ClustalW. I finalment, l'última isoforma s'alinea amb uns puntuació de 97 tant amb el transcrit de cinc com amb el de nou exons.
Encara que la funció de les tantes variants existents no s'acaben de conèixer, podem observar que la regió N-terminal de totes les isoformes és idèntica (els tres primers exons); i és aquesta regió la que forma part de la proteïna de fusió, de manera que se suggereix que aquests primers exons són els indispensables per a la funció.
La segona proteïna que conforma la quimèrica PML-RAR és la proteïna RARalfa (o RARA), component de la família de proteïnes RAR (retinoic acid receptor), que són receptors nuclears de l'àcid retinoic que funcionen com a factors de transcripció dependents de lligands. El gen que codifica per RARA es troba al cromosoma 17q12 (a la localització 35.715.972 - 35.770.420) i està format per setze exons. Han estat descrits dos transcrits diferents producte de l'splicing alternatiu, un de nou exons i un altre d'onze, que codifiquen, al mateix temps, per dues isoformes.
Figura 2. Representació gràfica dels transcrits del gen RARA.
El transcrit de nou exons està format per 3260 parells de bases, que conformen la part que posteriorment codificarà per una isoforma de 462 aminoàcids més els dos UTR dels extrems. El transcrit d'onze exons està format per 3395 parells de bases, que formaran una proteïna de 633 aminoàcids (en el transcrit també s'hi inclouen les dues regions UTR). La proteïna que obtenim de la traducció del primer transcrit (obtingut a la base de dades ENSEMBL) és exactament igual a la isoforma a (obtinguda a la base de dades UniProt). La proteïna obtinguda del segon transcrit i la isoforma b no són iguals, sinó que fent un ClustalW l'aparellament ens dóna una puntuació de 88. De totes maneres, si fem un BLAST de la segona isoforma obtinguda a UniProt contra tot el genoma humà, veiem que la regió genòmica que més se li assembla és, justament, el transcrit d'onze exons de la proteïna RARA, cosa que ens fa suposar que les diferències entre la proteïna de 633 aminoàcids que donaria el transcrit i la isoforma són a causa que no s'ha mantingut la pauta de lectura. Això vol dir que la diferència entre el transcrit i la isoforma afecta a una regió no codificant en la isoforma a, però afecta a una regió codificant en la isoforma b.
Taula 2. Representació dels transcrits del gen RARA.
El transcrit d'onze exons no té exons no codificants, tret de les regions UTR del començament del primer exó i el final de l'últim. Ara bé, el transcrit de nou exons té un exó no codificant, a part de les zones UTR del primer i últim exó no codificant. Així doncs, aquest transcrit té vuit exons codificants i un que no codifica que forma part de la regió UTR 5', per tant, és el primer exó del transcrit el que no es codifica.
Aquests dos transcrits descrits inclouen conjunts d'exons diferents degut a l'splicing alternatiu: dels setze exons que té el gen, els dos transcrits només en comparteixen quatre (de sencers). Malgrat això, els setze exons se solapen, fent que malgrat que els nou i onze exons que utilitza cada transcrit siguin diferents, la seqüència nucleotídica que queda a partir del segon exó del transcrit d'onze exons i a partir del tercer exó del transcrit de nou exons (cal recordar que el primer és no codificant) és pràcticament la mateixa (fent un ClustalW d'aquests dos fragment, l'alineament té una puntuació de 99).
Observant la proteïna de fusió, PML-RARA, veiem que està formada pels tres primers exons de la proteïna PML (que són iguals en qualsevol dels transcrits) i pels set últims de la RARA (que també són iguals en el dos transcrits).
Per tant, dels quatre transcrits de la PML es pot formar la proteïna de fusió amb qualsevol, ja que tenen els tres primers exons igual. I pel que fa als dos transcrits de la proteïna RARA, encara que el fragment que comparteixen amb la proteïna de fusió sigui pràcticament igual (puntuació de 99), el transcrit que se li assembla més és el de 9 exons.
| PML | |||||
| RARA |
Taula 3. Descripció dels gens PML i RARA.
Per trobar possibles gens ortòlegs en altres espècies de PML i de RARA, hem utilitzat la base de dades BIOMART i ENSEMBL, i hem comprovat que el percentatge d'identitat coincideix en tots els casos. La següent taula mostra una llista d'espècies que tenen algun gen ortòleg a PML, i el seu percentatge d'identitat amb aquesta proteïna humana:
| Espècie | Percentatge d'identitat amb PML humana | |
|---|---|---|
|
Pan troglodytes | |
|
Macaca mulatta | |
|
Felis catus | |
|
Bos taurus | |
|
Rattus norvegicus | |
|
Mus musculus | |
|
Tupaia belangeri | |
|
Loxodonta africana | |
|
Oryctolagus cuniculus | |
|
Echinops telfairi | |
|
Monodelphis domestica | |
|
Canis familiaris | |
|
Dasypus novemcinctus | |
|
Cavia porcellus | |
|
Gallus gallus | |
|
Ornithorhynchus anatinus |
Taula 4. Espècies amb gens ortòlegs de PML, i el seu percentatge d'identitat amb aquesta proteïna humana.
Tal com podem observar a la taula, ordenada de major a menor homologia entre espècies, la conservació de la proteïna segueix la filogènia de les espècies, conservant major homologia amb els primats no humans, que disminueix en rosegadors i menor homologia amb l'ornitorinc.
| Espècie | Percentatge d'identitat amb RARA humana | |
|---|---|---|
|
Macaca mulatta | |
|
Pan troglodytes | |
|
Loxodonta africana | |
|
Echinops telfairi | |
|
Erinaceus europaeus | |
|
Canis familiaris | |
|
Mus musculus | |
|
Rattus norvegicus | |
|
Monodelphis domestica | |
|
Danio rerio | |
|
Takifugu rubripes | |
|
Tetraodon nigroviridis | |
|
Xenopus tropicalis | |
|
Gasterosteus aculeatus | |
|
Dasypus novemcinctus | |
|
Ciona savignyi | |
|
Ciona intestinalis | |
|
Oryzias latipes | |
|
Cavia porcellus | |
|
Ornithorhynchus anatinus | |
|
Gallus gallus |
Taula 5. Espècies amb gens ortòlegs de RARA, i el seu percentatge d'identitat amb aquesta proteïna humana.
En aquesta taula podem observar que el gen RARA, comparat amb el de PML presenta homologia amb més espècies i sembla que va aparèixer abans a l'evolució perquè ja es troba en Ciona intestinalis. Pel que fa a aquest gen, no s'observa tant clarament que la proteïna segueixi la filogènia de les espècies, ja que podem veure que l'homologia amb Gallus gallus és la menor de totes. Això, però, és de difícil predir estudiant només l'evolució d'un gen en concret i no tot el genoma, on es veuria molt més clarament la major conservació en espècies més properes filogenèticament i una menor conservació en les que estan més allunyades en l'arbre de la vida.
Hi ha diverses bases de dades per conèixer l'expressió dels gens. Nosaltres hem utilitzat la de Gepis Tissue i els microarrays de Genome Browser. Entre les dues bases de dades hem trobat informació en part compartida i diferent en algunes altres parts. Els gràfics de continuació els hem obtingut amb la informació de Gepis Tissue i representen els teixits on hi ha expressió dels dos gens. Al primer gràfic es representen en lila els teixits on hi ha RARA i en verd els teixits on s'expressa PML. En general, cal destacar que RARA s'expressa en més teixits i en uns nivells d'expressió molt més elevats que PML. A més, a Gepis Tissue s'explica la diferència d'expressió de cada gen en cèl·lules sanes i en cèl·lules tumorals. Així doncs, pel que fa RARA, es troba en elevades concentracions en cèl·lules sanes del tracte gastrointestinal, de teixit cardíac, i de melsa, i en més baixes concentracions en vasos sanguinis i teixit nerviós. Per altra banda, PML es troba altament expressat en òs, node limfàtic, teixit nerviós i vasos, i en menys concentració a teixit cardíac. Cal dir que hem considerat una alta expressió de la proteïna el llindar de més de 60 unitats d'expressió. A la taula podem comprovar amb valors tot el que s'ha dit, entre el qual cal destacar que PML s'expressa en menys teixits que RARA.
Gràfic 1. Teixits amb alta expressió de PML o RARA.
Segons el que s'ha dit, els dos gens coincideixen en expressió en alguns teixits, tal com es mostra al següent gràfic. Aquests teixits són la glàndula adrenal, el cor, els pulmons, el teixit nerviós, entre els quals s'hi inclouen els nervis perifèrics, els testicles i el teixit vascular.
Gràfic 2. Teixits on s'hi expressa PML i RARA.
Cal destacar que en cas de cèl·lules tumorals els nivells d'expressió varien considerablement, així com els teixits on s'expressen. Pel que fa la proteïna PML, els seus nivells d'expressió són molt anormalment superiors en cèl·lules tumorals de la glàndula salival.
Per altra banda, els microarrays de la base de dades Genome Browser demostren, en part, el que hem observat als gràfics anteriors. Pel que fa el gen PML, els nivells d'expressió són molt baixos i es troba representat en pocs teixits. També, tal com ja havíem comprovat, l'expressió del gen RARA segons aquesta base de dades és més alta que el gen PML. A les dues figures següents hi ha l'expressió de cada gen a cada teixit normal de cèl·lules humanes. Els requadres de color negre corresponen als teixits on no s'expressen, els de color verd on l'expressió és baixa i en vermell o granatós on l'expressió és alta. A partir de les dues figures podem comprovar que els teixits on s'expressen els gens en part són diferents dels que havíem obtingut a la base de dades Gepis Tissue. El gen PML s'expressa a diferents parts de l'aparell reproductor masculí i femení, a l'ili, fetge, ronyons, cor i múscul abdominal. I el gen RARA s'expressa al cervell, diafragma, vesícula biliar, fetge, pulmons, ronyons, glàncula adrenal, timus i múscul abdominal.
Figura 3. Teixits on s'hi expressa PML.
Figura 4. Teixits on s'hi expressa RARA.
Utilitzant el servidor web del programa PROMO hem seleccionat els factors de transcripció que creiem que s'uneixen a la seqüència promotora del gen PML i del gen RARA. Com que els dos transcrits de RARA tenen regions promotores diferents, ho hem fet per RARA A i RARA B. Pel que fa a la PML però, tots els transcrits tenen les mateixa seqüència promotora, de manera que només ho hem fet una vegada. La seqüència promotora del gen està formada per 1 kilobase upstream del lloc de començament de la transcripció (TSS) i 100 parells de bases downstream del TSS. Hem intentat fer-ho amb una taxa de dissimilitud del 10%, però ho hem descartat ja que ens sortien més de dos mil possibles factors de transcripció. Hem anat reduint la taxa de dissimilitud fins al 3%, per tal d'obtenir un nombre més reduït i alhora més verosímil de possibles factors de transcripció que s'uneixen a la regió promotora dels nostres gens. Als següents enllaços (PML, RARA A i RARA B) mostrem els resultats obtinguts tant per PML com per RARA.
Els factors de transcripció marcats en lila i que mostrem a les taules següents (PML, RARA A i RARA B) són els que considerem com a més probables per a la unió a la regió promotora. Per fer aquesta selecció hem determinat un valor llindar de RE query (probabilitat que un factor de transcripció tingui una seqüència complementària a part de la regió promotora sense ser un factor que s'uneixi al promotor) de 0,09 i una dissimilitud menor a l'1%. Malgrat això, pel que fa al promotor de RARA ens apareixen molts possibles factors de transcripció que s'hi uneixen. Sabem que és força improbable que n'hi hagi tants, però hem preferit mantenir els llindars iguals i no disminuir el llindar de dissimilitud, ja que reduint-lo a zero, podria ser possible que no tinguéssim en compte tots els possibles factors de transcripció (no sempre s'uneixen amb una similitud del 100%). Es pot observar que hi ha factors de transcripció que es repetien a la taula on hi eren tots i que ara només n'hem seleccionat un: això és perquè hem seleccionat només el que tenia el RE query i la dissimilaritat menor. Com que aquests dos valors eren els mateixos i només variava la localització on s'unia dins la regió promotora, els hem mantingut tots dos.
Un cop tenim els factors de transcripció que hipotitzem que s'uneixen a les regions promotores dels gens que estudiem, elaborem un algorisme en Perl que ens permeti fer el mateix i que, a partir d'una matriu d'ocurrències d'un nombre reduït de factors de transcripció i una seqüència promotora determinada, ens digui quins són els factors que s'hi uneixen (els que aconsegueixen una puntuació positiva), en quina posició i quina és la proporció que aquest resultat, en realitat, sigui degut a l'atzar (a partir del valor de p-value). A partir de la comparació dels dos resultats del PROMO i del programa Perl, pretenem matisar quins són els factors de transcripció que regulen els gens PML i RARA.
Per poder executar el programa Perl, cal tenir guardat a l'ordinador els següents arxius de text: matrius.txt, pml.txt, raraA.txt i raraB.txt.
| Factor de transcripció | Posició inicial | Posició final | Seqüència | p-value |
|---|---|---|---|---|
| NF-AT1 | 679 | 685 | TAACCCC | 0,07 |
| YY1 | 532 | 537 | TAGGTC | 0,45 |
| RXRalfa | 116 | 121 | GAATCA | 0,59 |
| PU,1 | 591 | 597 | ACAGAAGTGA | 0,01 |
Taula 6. Factors de transcripció per RARA obtinguts pel programa.
| Factor de transcripció | Posició inicial | Posició final | Seqüència | p-value |
|---|---|---|---|---|
| AhR | 629 | 635 | ATCTTTG | 0,05 |
Taula 7. Factors de transcripció per PML obtinguts pel programa.
Aquests resultats obtinguts amb el programa Perl cal comparar-los amb els del servidor web PROMO. Fem la comparació només amb PML i la isoforma a de RARA i descartem la isoforma b, ja que com hem dit anteriorment la proteïna de fusió es produeix amb la isoforma a i és aquesta la que estudiem. Els resultats de PROMO dels factors de transcripció que coincideixen entre els dos mètodes d'obtenció de possibles factors de transcripció estan resumits a les següents taules (de totes maneres, es poden obtenir a les taules linkades abans):
| Factor de transcripció | Posició inicial | Posició final | Dissimilaritat | Seqüència | RE-equally | RE-query |
|---|---|---|---|---|---|---|
| NF-AT1 | 188 | 196 | 0,6 | GGAAAATAT | 0,01 | 0,01 |
| YY1 | 838 | 844 | 0 | CCATCTT | 0,07 | 0,08 |
| RXRalfa | 893 | 903 | 0,86 | CTGACCCAGTC | 0,01 | 0,01 |
| PU,1 | 577 | 585 | 0,97 | CATGAGGAA | 0,05 | 0,06 |
Taula 8. Factors de transcripció per RARA obtinguts per PROMO.
| Factor de transcripció | Posició inicial | Posició final | Seqüència | p-value | ||
|---|---|---|---|---|---|---|
| AhR | 940 | 947 | 0,17 | GCTCACGC | 0,03 | 0,05 |
Taula 9. Factors de transcripció per PML obtinguts per PROMO.
Com es pot observar, malgrat que hi ha factors de transcripció que coincideixen (NF-AT1, YY1, RXRalfa i PU,1 per RARA i AhR per PML) i que, per tant, podríem considerar que són els factors de transcripció que s'uneixen a la regió promotora del gen PML i RARA respectivament, aquests no coincideixen ni en la posició ni en la seqüència de nucleòtids on s'uneixen. Això pot ser a causa de diferents motius: d'una banda cal tenir en compte que les matrius d'ocurrències amb les que es basa PROMO i amb les que es basa el nostre programa no són les mateixes, de manera que és normal que hi hagi petites diferències. A més, el nostre programa Perl assumeix una dissimilaritat del 0%, cosa que no fa PROMO (que li hem donat un marge de fins a l'1% de dissimilaritat) i per tant, és possible que la seqüència de nucleòtids no sigui la mateixa. Una altra opció a tenir en compte, però, és que malgrat que el nostre programa Perl funciona i és executable, l'algorisme tingui alguns errors que faci diferir uns resultats dels altres.
La proteïna PML, descoberta originalment en pacients de leucèmica promielocítica aguda, forma els cossos nuclears, un complex multiproteic que en patologia es dispersa en centenars punts minúsculs pel nucli i el citoplasma de les cèl·lules. Totes les variants de PML tenen la mateixa regió N-terminal i difereixen en les seves seqüències terminals. La regió N-terminal, probablement indispensable per la funció de la proteïna, consta d'un ring-finger, dues b-box i un domini alfa-helix colied-coil, essencials per la formació dels cossos nuclears. Les interaccions de PML els fan actuar com a supressors del creixement, amb activitats apoptòtiques i antivíriques.
La proteïna RARA forma part de la família de receptors de l'àcid retinoic, que alhora formen, juntament amb els receptors per esteroides i les hormones tiroidees, una nombrosa família de proteïnes dependents de lligand reguladores de gens. L'àcid retinoic és un metabòlit amb importants efectes sobre el desenvolupament de vertebrats; un morfogen teratogènic que controla la funció cel·lular regulant directament l'expressió gènica. Es localitza al nucli de la cèl·lula i està formada per tres dominis: un domini N-terminal modular, un d'unió al DNA (amb dos dits de zinc) i un domini C-terminal d'unió a esteroides. Els dos primers dominis es troben altament conservats. S'han identificat tres tipus de receptors d'àcid retinoic (RAR): RARalfa, RARbeta i RARgamma, els tres codificats per gens en cromosomes separats. S'han descrit isoformes addicionals amb diferències a la regió N-terminal.
Leucèmia promielocítica aguda
El gen de fusió produït per la translocació recíproca dels dos cromosomes t(15;17) genera una proteïna quimèrica aberrant que exerceix funcions oncogèniques crítiques. La presència d'aquesta proteïna provoca una leucèmica promielocítica aguda, caracteritzada per una deficiència de cèl·lules sanguínies madures i un excés de cèl·lules immadures anomenades promielòcits.
La leucèmia promielocítica aguda es va descriure com a malaltia l'any 1957 i explica entre el 5 i el 10% dels casos de leucèmia mieloide aguda (AML). La incidència és majoritària en adults joves, que presenten uns signes i símbols poc específics que inclouen cansament, infeccions menors, tendència de sagnar, anèmia, baixos nivells dels granulòcits, monòcits i plaquetes.
La translocació de t(15;17) a APL és el resultat de dues ruptures de cromosomes: una al cromosoma 15 i l'altra al cromosoma 17. La ruptura del cromosoma 15 interromp el gen PML, que en condicions normals codifica per un factor de transcripció supressor del creixement. La ruptura del cromosoma 17 interromp el gen RARA, que regula la diferenciació mieloide. La translocació crea un gen de fusió de PML-RARA. Produeix una proteïna quimèrica que atura la maduració de cèl·lules mieloides a l'estadi promielocític. I això condueix a un augment de la proliferació de promielòcits.
El tractament per aquest tipus de leucèmia és l'administració d'all-trans-retinoic acid (ATRA), que activa els RAR fent madurar els promielòcits i evitant que proliferin, juntament amb la quimioteràpia. Amb aquest tractament, malgrat que no es pot eliminar la translocació, s'aconsegueix entre un 75% i un 90% de curació.
Per estudiar la proteïna PML-RAR, que és una proteïna quimèrica, que només s'observa en pacients de leucèmia promielocítica aguda a causa d'una translocació cromosòmica recíproca entre els cromosomes 15 i 17, hem fet un estudi genòmic computacional de les proteïnes PML i RARA, separadament. L'estudi ens ha permès conèixer l'estructura genòmica dels dos gens, coneixent la seva localització cromosòmica, els transcrits i les diferents isoformes que presenten, la seva conservació d'aquestes proteïnes al llarg de l'evolució per poder determinar la importància de la seva funcionalitat o conèixer els teixits on s'expressen.
La part central del treball, però, ha estat poder determinar quins factors de transcripció s'uneixen a la regió promotora de cada un dels gens. Per fer-ho hem utilitzat dos mètodes diferents: el servidor PROMO, disponible a Internet i un programa en llenguatge Perl, fet per nosaltres que a partir d'unes matrius d'ocurrències determinades i la seqüència del promotor prediu quins factors de transcripció s'uneixen a la regió promotora i, per tant, són els responsables de la regulació dels gens. La hipòtesi en què ens basàvem partia de la idea que els resultats obtinguts pels dos mètodes amb què hem estudiat la regió promotora coincidirien, però en realitat el grau de coincidència no ha estat tan elevat com esperàvem. De totes maneres, podem concloure que, dels tretze factors de transcripció possibles (teníem tretze matrius d'ocurrències), el gen PML és regulat pel factor de transcripció AhR, i el gen RARA, per NF-AT1, YY1, PU,1 i RXRalfa. En el fons, però, la conclusió final és que caldria perfeccionar el programa i augmentar el nombre de matrius d'ocurrències per poder acostar-nos més a la realitat.